Необходимость применения антибиотиков
Чтобы предотвратить дальнейшее распространение заболевания и обеспечить стабильность работы предприятия без значительной утраты продуктивности, необходимо оперативно провести лечение животного. Таким образом антибиотики являются жизненной необходимостью из-за эффективного антибактериального действия и отсутствия столь же эффективных и доступных аналогов. Применение антибиотиков является жизненной необходимостью, особенно в текущих условиях ведения сельского хозяйства, с высокой эпизоотической нагрузкой.
Использование антибактериальных препаратов в качестве ростостимулирующих агентов (AGP – antimicrobial growth promotors; кормовые антибиотики) является распространённой практикой в животноводстве. Важно уточнить что дозировки препаратов в данном случае являются сублетальными для целевых патогенных микроорганизмов.
Эффект стимуляции роста объясняется несколькими теориями (Rahman et al., 2022; Niewold 2007):
- подавление субклинических инфекций;
- снижение содержания в организме подавляющих рост метаболитов микробной активности;
- снижение потребления питательных веществ корма микроорганизмами;
- улучшение всасываемости и усвояемости питательных веществ в связи с истончением кишечной стенки, эффектом, сопутствующим применение антибактериальных препаратов;
- снижение интенсивности воспалительных процессов;
Кормовые антибиотики подавляя интенсивность воздействия на организм субклинических инфекций снижают затраты питательных веществ и энергии необходимых для обеспечения активности иммунной системы. Однако эта теория хотя и кажется логичной имеет ряд проблем – кормовые антибиотики даются в дозировке, не оказывающей летальное действие на целевые патогенные микроорганизмы и хроническое воздействие сублетальных доз препаратов приводят к развитию у патогенных микроорганизмов антибиотикорезистентности (Aarestrup et al., 2001; Teuber 2001).
Теории о снижении выработки ростоподавляющих метаболитов и снижении использования патогенными микроорганизмами питательных веществ так же имеют слабые стороны – эти теории основаны на предположении о том, что определенные популяции бактерий могут быть селективно подвержены антибактериальному действию кормовых антибиотиков. Хотя этот эффект действительно наблюдается при использовании антибактериальных препаратов в минимальной ингибирующей концентрации (МИК), он не проявляется при использовании сублетальных дозировок. При этом, так как селективное действие невозможно, воздействию кормовых антибиотиков подвергаются все микроорганизмы.
В отношении теории об улучшении всасываемости и усвояемости питательных веществ в связи с истончением кишечной стенки, можно выделить следующие требующие внимания аспекты: во-первых, нет подтвержденной корреляции между толщиной стенки кишечника и эффективности процессов всасывания питательных веществ. Известно, что на эффективность процессов всасывания влияет площадь рабочей поверхности кишечника, а антибактериальные препараты не могут увеличивать эффективную площадь поверхности кишечника (Pappenheimer 1998).
В пользу теории о подавлении воспалительных процессов говорят универсальность воздействия при применении кормовых антибиотиков – применение и в кормлении птицы, и в кормлении свиней и крупного рогатого скота позволяет добиваться повышенной скорости набора живой массы, несмотря на разный состав микрофлоры и устройство желудочно-кишечного тракта (Lu et al., 2003). Все антибактериальные препараты имеют целевые группы микроорганизмов, против которых они эффективны, но несмотря на это применение разных групп кормовых антибиотиков все равно стимулирует набор живой массы.
Ростостимулирующий эффект антибактериальных препаратов объясняется тем, что всем антибиотикам свойственно накопление в воспаленных клетках и подавление интенсивности воспалительного процесса. (Niewold 2007) Помимо этого, антибактериальные препараты стимулируют активность митохондрий, тем самым так же позволяя проявлять кормовым антибиотикам ростостимулирующую активность (Miyakawa et al., 2024).
И так как с каждым годом появляется все больше антибиотикорезистентных штаммов бактерий существует острая потребность в снижении их использования.
У бактерий отмечается сильно выраженная генетическая пластичность, позволяющая им с легкостью адаптироваться к воздействию различных неблагоприятных факторов, включая бактерицидное или бактериостатическое действие антибиотиков (D’Costa et al., 2011).
Из-за того, что в течение эволюции бактерии тесно контактировали с продуцентами антибиотиков, у бактерий выработан механизм защиты от пагубного действия антибиотиков. При этом сами механизмы могут появляться либо благодаря мутации, либо благодаря горизонтальному переносу необходимых генов (Munita 2016).
Устойчивость к одному классу антимикробных препаратов обычно достигается за счет нескольких биохимических путей, и одна бактериальная клетка может использовать целый набор механизмов устойчивости (Wubetu et al., 2024).
В общем механизмы антибиотикорезистентности можно разделить по биохимическим механизмам (Munita 2016):
1. Модификации антимикробной молекулы
Одна из наиболее успешных бактериальных стратегий борьбы с присутствием антибиотиков заключается в производстве ферментов, которые инактивируют препарат путем присоединения к нему определенных химических соединений, делая антибиотик неспособным взаимодействовать со своей мишенью. Такая стратегия устойчивости присуща как грампозитивным, так и грамнегативным бактериям (Wilson 2014).
Яркий пример ферментативного изменения антибиотика - модификация хлорамфеникола, антибиотика, который ингибирует синтез белка, взаимодействуя с центром пептидилтрансферазы 50S рибосомальной субъединицы. Химическая модификация хлорамфеникола происходит в основном за счет экспрессии ацетилтрансфераз, известных как ХАТ (хлорамфеникол ацетилтрансферазы). Множество генов ХАТ было описано как у грамположительных, так и у грамотрицательных организмов (Schwarz et al., 2004). Хотя эти детерминанты обычно содержатся в плазмидах и транспозонах, сообщалось также, что они являются частью основного генома некоторых бактерий.
2. Уничтожение молекулы антибиотика
Основной механизм устойчивости к β-лактамам основан на разрушении этих соединений под действием β-лактамаз. Эти ферменты разрушают амидную связь β-лактамного кольца, делая антибиотик неэффективным. Впервые β-лактамазы были описаны в начале 1940-х годов, за год до появления на рынке пенициллина (Bush 2013).
3. Предотвращение достижения антибиотиком мишени (путем снижения проникновения или активного удаления из клетки антимикробного соединения).
Многие антибиотики направлены на внутриклеточные бактериальные мишени или, в случае грамотрицательных бактерий, на мишени, расположенные в цитоплазматической мембране. Поэтому для оказания антимикробного действия антибиотик должен проникать через внешнюю и/или цитоплазматическую мембрану. Бактерии разработали механизмы, препятствующие достижению антибиотиком внутриклеточной или внутриплазматической цели путем снижения поглощения антимикробных молекул. Этот механизм особенно важен для грамотрицательных бактерий (Pagès et al., 2008).
4. Изменения и/или блокировка целевых белков, на которые воздействуют антибиотики
Обычная стратегия развития устойчивости бактерий к противомикробным препаратам заключается в том, чтобы избегать действия антибиотиков путем воздействия на их целевые участки. Для достижения этого бактерии разработали различные тактики, включая защиту мишени (предотвращение попадания антибиотиков в сайт связывания) и модификацию сайта-мишени, что приводит к снижению способности молекул антибиотика вступать с сайтом в реакцию.
Защита мишени.
Одним из классических и хорошо изученных примеров этого целевого механизма защиты являются детерминанты устойчивости к тетрациклину - TetO и TetM, которые первоначально были описаны у Streptococcus и Campylobacter соответственно, но в настоящее время широко распространены среди различных видов бактерий. Они взаимодействуют с рибосомой, вытесняя тетрациклин из его места связывания с белком. Кроме того, взаимодействие с этими детерминантами изменяет конформацию рибосомы, предотвращая повторное присоединение антибиотика (Dönhöfer et al., 2012).
Модификация целевого белка антибиотиков.
Внесение модификаций в целевой белок является одним из наиболее распространенных механизмов устойчивости к антибиотикам среди бактериальных патогенов, влияющих почти на все семейства противомикробных соединений. Эти изменения могут состоять из точечных мутаций в генах, кодирующих участок белка, ферментативных изменений места связывания с белком (например, добавления метильных групп). Независимо от типа изменения, конечный результат всегда один и тот же: снижение сродства антибиотика к целевому участку (Connel et al., 2003).
Мутации целевого сайта.
Одним из классических примеров мутационной устойчивости является развитие устойчивости к рифампицину. Рифампицин - это рифамицин, который блокирует бактериальную транскрипцию путем ингибирования ДНК-зависимой РНК-полимеразы.
Резистентность к рифампицину высокого уровня возникает в результате одноэтапных точечных мутаций, приводящих к аминокислотным заменам в гене rpoB (Floss et al., 2005).
Ферментативное изменение сайта-мишени.
Одним из наиболее характерных примеров устойчивости за счет ферментативной модификации сайта-мишени является метилирование рибосомы, катализируемое ферментом, кодируемым генами erm (рибосомальное метилирование эритромицина), которое приводит к устойчивости к макролидам (Leclercq 2002).
Полная замена или обход целевого сайта.
Используя эту стратегию, бактерии способны вырабатывать новые мишени, которые выполняют аналогичные биохимические функции исходной мишени, но не ингибируются молекулой антибиотика (Hiramatsu et al., 2013).
5. Устойчивость, обусловленная глобальными адаптивными процессами клетки
В настоящее время схожей эффективностью действия в сравнении с ростостимулирующим антибактериальным препаратам являются фитобиотики – они так же оказывают достаточно эффективное противовоспалительное действие, но при этом не способствуют развитию у бактерий антибиотикорезистентности.
В группу фитобиотиков включают травы, части растений (листья, корни, цветки целиком или обработанные каким-либо образом), эфирные масла, олеорезины и синтезированные действующие вещества (Rossi et al., 2020; Kuralkar, 2021). Содержание действующих веществ в фитобиотических добавках сильно зависит от того какая часть растения использовалась, в каком регионе было выращено растение и погодных условий (Burt 2004; Bakkali et al. 2008; Windisch et al. 2008).
Например, по данным исследований «в эфирном масле тимьяна содержание тимола и карвакрола может варьироваться от 3% до 60%». (Lawrence et al., 1984) Из-за такой особенности в содержании действующих веществ эффективность действия фитобиотических добавок основанных не на чистых выделенных активных компонентах сильно разнится (Schilcer 1985; Janssen et al., 1989; Deans 1993).
Свойства фитобиотиков
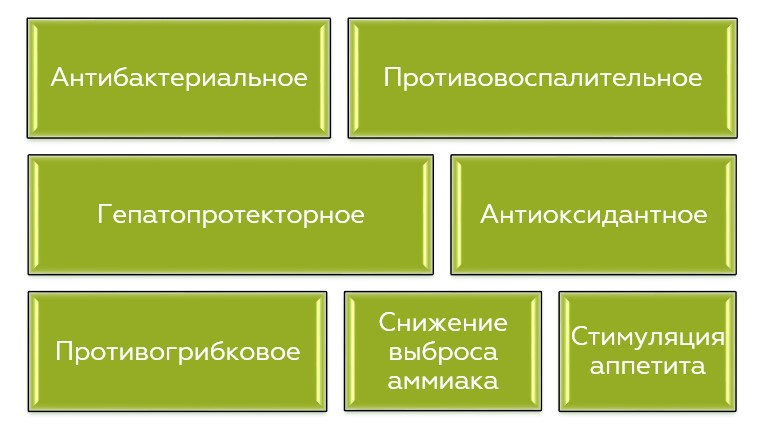
Фитобиотики – смесь различных вторичных метаболитов растительного происхождения. Вторичные метаболиты растительного происхождения представляют собой довольно разнообразную группу веществ, благодаря чему обладают широким спектром свойств - помимо антибактериального действия они обладают противовоспалительным, антиоксидантным, гепатопротекторным и противогрибковым действием, а также способствуют снижению выброса аммиака в окружающую среду и стимуляции аппетита (Kumar et al., 2014; Lillehoj et al., 2018; Kuralkar 2021).
Общий механизм бактериостатической активности вторичных метаболитов заключается в способности ингибировать или нарушать бактериальное чувство кворума. Из-за обширности химических классов вторичных метаболитов механизмы антибактериального действия для разных соединений различны (Szabo et al., 2010).
Чувство кворума — это способность микроорганизмов регулировать выработку белков в ответ на изменения в количестве бактерий. Этот процесс происходит благодаря производству и восприятию химических сигнальных молекул, концентрация которых меняется в зависимости от количества бактерий. Ярким примером действия чувства кворума является становление E. Coli патогенными при достижении определенного количества бактерий.
Грамположительные и грамотрицательные бактерии используют сложные метаболические сети, основанные на чувстве кворума, чтобы управлять своей физиологической активностью. Это включает симбиоз, вирулентность, конъюгацию, выработку антибиотиков, подвижность, спорообразование и формирование биопленок.
Благодаря такому комплексу свойств вторичные метаболиты растительного происхождения могут снизить степень негативного воздействия патогенных микроорганизмов и их устойчивость к антибактериальным препаратам, то есть оказать сенсибилизирующий эффект при совместном использовании с антибиотиком (Ishida et al., 2008; Szabo et al., 2010).
Иммуномодулирующий эффект на организм животных заключается в улучшении иммунитета слизистой оболочки желудочно-кишечного тракта и повышение сопротивляемости к колонизации различными патогенными микроорганизмами (Kiczorowska et al., 2017). Помимо этого, вторичные метаболиты растительного происхождения способны усиливать активность клеток иммунной системы - лимфоцитов, макрофагов, клеток киллеров (Kiczorowska et al., 2017). Так же за счет антиоксидантной и противовоспалительной активности вторичных метаболитов достигается и гепатопротекторный эффект (Khatun 2023).
Антиоксидантное действие вторичных метаболитов заключается в активации фактора Nrf2, который инициирует выработку различных антиоксидантных белков и ферментов Противовоспалительное действие оказывается за счет снижения активности воспалительных факторов (Shimizu, 2017).
За счет привлекательного запаха, которым обладают некоторые из вторичных метаболитов растительного происхождения, они способствуют повышению потребления животными кормов.
Вторичный метаболиты растительного происхождения представлены довольно обширной группой веществ. Однако наиболее коммерчески распространенными вторичными метаболитами растительного происхождения являются тимол и карвакрол, эвгенол, коричный альдегид, сангвинарин, хелеретрин.
Тимол
Тимол содержится в таких растениях как Тимьян, Монарда, Душица/Орегано, однако в основном тимол получают из видов тимьяна (Ezzat et al. 2016). Молекула тимола является природным фенолом и изомерна другому вторичному метаболиту – карвакролу (Austgulen et al., 1987).
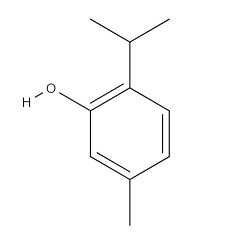
Рисунок 1. Структурная формула тимола.
В чистом виде тимол – белый кристаллический порошок, обладающий выраженными антисептическими свойствами и имеющий приятный аромат. Слабо растворим в воде. По результатам множества исследований тимол оказывает антиоксидантное, противомикробное, иммуномодулирующее, противовирусное и противовоспалительное действие (Abd et al., 2015; Di Pasqua et al., 2006).
Механизм антибактериального действия тимола и карвакрола заключается в воздействии на бактериальную клеточную мембрану, приводящему к утрате мембранного потенциала и нарушению синтеза АТФ, нарушению проницаемости мембраны, ингибированию транспорта и использованию глюкозы (Borneman et al., 1986; Hashimoto et al., 1999; Tsuchiya and Linuma, 2000; Lambert et al., 2001; Gill and Holley, 2006; Oussalah et al., 2006). Еще одним из значимых эффектов является увеличение чувствительности антибиотикорезистентных штаммов к антибактериальным препаратам.
Так же тимол имеет выраженное положительное действие на антиоксидантную систему организма (Youdin and Deans, 1999).
Карвакрол
Карвакрол в основном получают из орегано, тимьяна, дикого бергамота. Карвакрол представляет из себя жидкость, с таким же вкусом и запахом, как и тимол. Слабо растворим в воде (Ultee et al., 2000; Yadav and Kamble, 2009).
Карвакрол обладает антиоксидантными, противомикробными, противогрибковыми, иммуномодулирующими и противовоспалительными свойствами (Alagawany M. et al; 2015). Карвакрол относится к классу фенольных соединений, чем объясняется механизм его антибактериального и противовоспалительного действия.
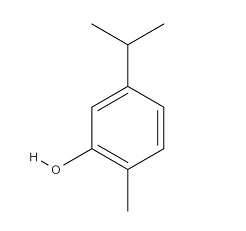
Рисунок 2. Структурная формула карвакрола.
Механизм противовоспалительного и антиоксидантного действия такой же, как и у тимола.
Особенностью антибактериального действия карвакрола является способность ингибировать синтез белка флагеллина, ответственного за образование жгутиков микроорганизмов (Burt et al., 2007).
Противогрибковое заключается в разрушении эндоплазматического ретикулума и компонентов клеточной мембраны (Kumar et al., 2021). При этом карвакрол демонстрирует синергетический эффект в сочетании с обычными противогрибковыми препаратами, такими как флуконазол, кетоконазол (Nóbrega et al., 2019; Khodavandi et al., 2018). В сочетании с флуконазолом или амфотерицином B карвакрол снижает активность фермента секретируемых аспаргиновых протеиназ и уменьшает экспрессию генов (Khodavandi et al., 2018).
Эвгенол
Эвгенол получают из лавра, базилика, корицы, гвоздики. Представляет собой прозрачную или светло-желтую жидкость маслянистой консистенции и с пряным ароматом. Малорастворим в воде (Ulanowska M. et al; 2021).
Эвгенол обладает антиоксидантными, противовоспалительными и антибактериальными свойствами (Dahiya et al., 2006; Ulanowska M. et al; 2021). Эвгенол относится к классу фенольных соединений, из-за чего механизм его антибактериального, антиоксидантного и противовоспалительного действия схож с принципом действия других вторичных метаболитов фенольного ряда.
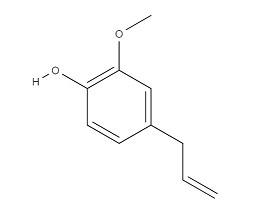
Рисунок 3. Структурная формула эвгенола.
Антиоксидантная активность эвгенола заключается в препятствии образования свободных радикалов и стимулирования выработки антиоксидантных белков (Gülçin, 2011).
Противовоспалительный эффект достигается за счет подавления активности факторов, способствующих развитию и усилению воспалительных процессов (Fonsêca et al., 2016).
Эвгенол проявляет мощную антибактериальную активность против различных патогенов, включая Salmonella typhi и Escherichia coli (Devi et al., 2010; Jeyakumar, 2020). Механизм его действия заключается, прежде всего, в разрушении клеточной мембраны бактерий, повышении проницаемости и вытекании внутриклеточного содержимого (Devi et al., 2010; Jeyakumar & Lawrence, 2020).
При этом эвгенол демонстрирует синергетический эффект с некоторыми антибиотиками, например, с хлорамфениколом против E. coli, и одновременно проявляет антагонистический эффект с другими (Bezerra et al., 2023).
Коричный альдегид
Коричный альдегид получают из представителей рода Коричников. Представляет собой желтоватую жидкость. Коричный альдегид имеет антибактериальное, противовоспалительное, антиоксидантное, противогрибковое действие, при этом применение в кормлении жвачных стимулирует рост полезной микрофлоры и улучшает поступление в организм микробиального белка (Amlan K., 2011; García-Rodríguez J. et al, 2024).
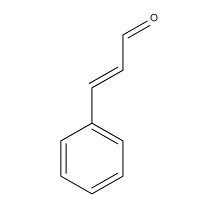
Рисунок 4. Структурная формула коричного альдегида.
Антибактериальное действие коричного альдегида заключается так же в нарушении проницаемости мембраны и нарушении энергетического метаболизма (Doyle et al., 2019).
Противовоспалительное действие обусловлено подавлением активности провоспалительного фактора NF-κB (Kim et al., 2007).
Антиоксидантное действие коричный альдегид оказывает посредством предотвращения активности свободных радикалов.
Противогрибковое действие коричного альдегида объясняется наличием сульфгидрильных групп, способствующих нарушению деления клеток и замедлению клеточного метаболизма (Bang et al., 2000).
Сангвинарин
Сангвинарин это вторичный метаболит, относящийся к классу алкалоидов и в основном получаемый из Маклеи Сердцевидной и других растений семейства маковых (Shamma and Guinaudeau, 1986). Представляет собой желтоватый кристаллический порошок.
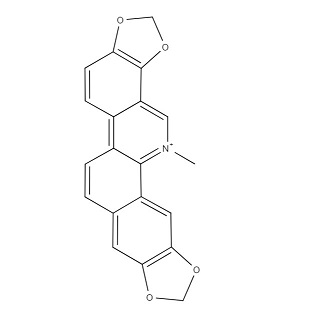
Рисунок 5. Структурная формула сангвинарина.
Механизм антибактериального действия сангвинарина заключается в нарушении целостности и проницаемости клеточной стенки и мембран. Так же сангвинарин индуцирует развитие окислительного стресса (Gu et al., 2023).
Противовоспалительный эффект заключается в подавлении активности воспалительных медиаторов (Niu et al., 2012).
При использовании сангвинарина в кормлении отмечается повышение привесов, улучшение конверсии корма (Liu et al., 2020; Lee et al., 2015). Так же сангвинарин стимулирует рост ворсинок и увеличивает количество полезной микрофлоры кишечника. При этом сангвинарин так же улучшает качество мяса, путем воздействия на метаболический путь PPAR, снижая уровень перекисного окисления жиров в мясе (Su et al., 2024; Lee et al., 2015).
Хелеретрин
Хелеретрин является алкалоидом, метаболитом растений семейства маковых, обладает противовоспалительным и антибактериальным действием (Dvořák et al., 2006; Wang et al., 2013).
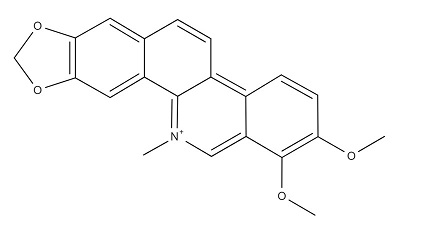
Рисунок 6. Структурная формула хелеретрина.
Антибактериальное действие заключается в способности к разрушению клеточной стенки и мембран. Помимо этого, хелеретрин подавляет биосинтез белка (He et al., 2018; Xin et al., 2024). Одной из важных особенностей хелеретрина является его способность сенсибилизировать к действию антибактериальных препаратов антибиотикоустойчивые бактерии (Wang et al., 2020).
Противовоспалительный эффект заключается в подавлении активности воспалительных медиаторов (Niu et al., 2011).
На данный момент чаще всего применяется в животноводстве в качестве антибактериального агента, благодаря выраженному антибактериальному действию.
Силимарин
Силимарин является основным действующим веществом в растениях семейства Расторопш. Имеющиеся в литературе данные указывают на то, что силимарин действует четырьмя различными способами (Luper, 1998; Valenzuela et al., 1986; Fraschini, 2002):
- как антиоксидант и регулятор внутриклеточного содержания глутатиона;
- как стабилизатор клеточных мембран и регулятор проницаемости, препятствующий проникновению гепатотоксических агентов в гепатоциты;
- как промотор синтеза рибосомальной РНК, стимулирующий регенерацию печени;
- как ингибитор превращения гепатоцитов в миофибробласты - процесса, ответственного за отложение коллагеновых волокон, приводящего к циррозу.
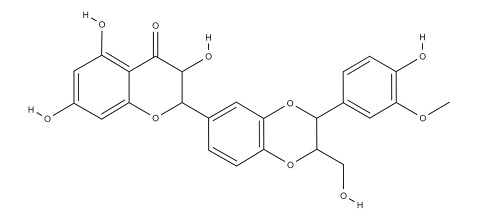
Рисунок 7. Структурная формула силимарина.
В кормлении птицы силимарин может улучшить показатели роста, яйценоскость и характеристики туши (Abd El-Ghany, 2022; Gaweł et al., 2003). Он также улучшают антиоксидантный статус, иммунный ответ и здоровье кишечника у птиц (Abd El-Ghany, 2022). Силимарин продемонстрировал гепатопротекторные свойства у различных животных, включая домашнюю птицу, собак, кошек и лошадей (Tedesco & Guerrini, 2022). Кроме того, добавка силимарина может снизить содержание липидов в мышцах и повысить окислительную устойчивость мяса птицы (Schiavone et al., 2007).
В кормлении свиней, помимо улучшения качества мяса, отмечается улучшение среднесуточного прироста, потребления корма и усвояемости питательных веществ (Hossain et al., 2023; Koo et al., 2022). Силимарин также положительно повлиял на здоровье кишечника, увеличив количество лактобактерий и снизив популяцию кишечной палочки (Hossain et al., 2023; Koo et al., 2022).
Гингколид и Билобалид
Гинкголид и Билобалид относятся к группе лактонов и являются активными действующими веществами растений семейства Гингковых. Обладают выраженными антиоксидантными и противовоспалительными свойствами.
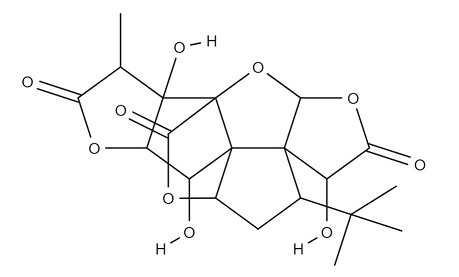
Рисунок 8. Структурная формула гингколида.
Использование гингколида и билобалида в кормлении может улучшить производительность и иммунную функцию цыплят-бройлеров. Добавление в рацион повысило эффективность кормления, прирост веса и иммунные показатели (L. Yan, 2008).
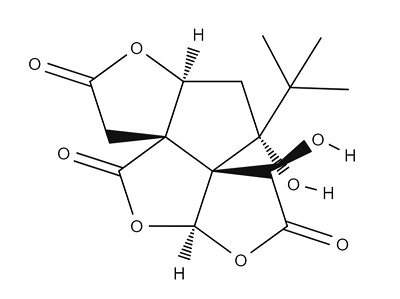
Рисунок 8. Структурная формула билобалида.
Билобалид и гингколид оказывают благотворное влияние на рост и здоровье свиней. При их использовании в кормлении поросят-отъемышей значительно улучшались показатели роста, биохимические параметры сыворотки крови и уровень гормонов, связанных с ростом (L. Yan, 2011; Huang Qi-chu, 2014).
Фитобиотики МИСМА
Хотя фитобиотические добавки и обладают большим потенциалом и широким спектром действия, использование их в комбинации позволяет добиться значительно лучшего эффекта. При этом, как упоминалось ранее, лучшей стабильностью и активностью обладают препараты, основанные на синтезированных действующих веществах.
Примером таких разработок являются фитобиотики МеноХерб и Биопромис Фито АВ3.
МеноХерб защищен жировой оболочкой и основан на синтезированных действующих веществах. Эти свойства обуславливают высокую эффективность действия. МеноХерб оказывает антибактериальное, противовоспалительное и антиоксидантное действие, повышает поедаемость кормов.
Биопромис Фито АВ3 обладает высокой антиоксидантной активностью, позволяют частично заменить витамин Е, способствует повышению качества репродуктивного материала и улучшает качество мяса.
Заключение
Фитобиотики – группа уникальных и универсальных кормовых добавок, имеющих широкий спектр применения.
Благодаря эффективному антибактериальному действию и улучшению состояния кишечника (снижение интенсивности воспалительных процессов, иммуномодулирующее действие) фитобиотики могут оказывать столь же эффективное действие, как и кормовые антибиотики.
А за счет способности к сенсибилизации антибиотикоустойчивых патогенов фитобиотики могут значительно повысить эффективность проводимого лечения.
Таким образом применение фитобиотиков позволит улучшить эпизоотическую обстановку и повысить продуктивность животных.
Статья подготовлена техническим отделом Мисма, декабрь 2024г.




